详解CAR-NK前瞻性改造与CAR结构迭代,助力疗效与安全性提升
发布时间:2024-11-24来源:点击:1115
以下文章来源于医麦客
在细胞疗法朝着通用型、攻克实体瘤的大发展趋势下,CAR-NK疗法已然处于“风口”。近年来,CAR-NK疗法的研发不断升级加速,其CAR结构也经历了多次迭代,基于不同的跨膜区和细胞内共刺激域的模块化组合的优化结构设计,CAR-NK细胞的效力和持久性得到有效提升。
CAR-NK的CAR通常由三部分组成:胞外结构域、跨膜结构域以及胞内激活结构域。胞外结构域由信号肽、识别抗原的单链抗体片段(scFv)和铰链区组成。这些结构的组合连同调控元件(例如启动子)将决定CAR的功效。
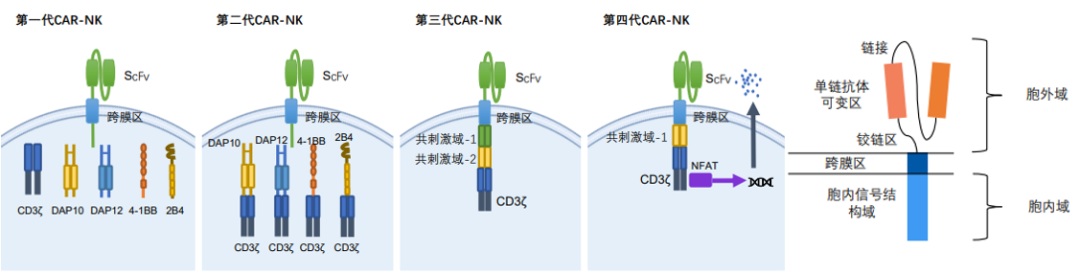
四代CAR-NK
1
载体骨架和启动子
载体骨架包含表达CAR所需的所有元件,包括启动子、转录调控片段和聚腺苷酸化信号(polyA信号)。特定启动子的选择对转基因的表达水平有直接影响,且可能受到scFv序列本身的影响。目前,尚难以确定CAR-NK细胞的最佳启动子。但已有研究报道,在原代CAR-NK和CAR-NK细胞系中,病毒启动子(如CMV、MPSV、MMLV、SFFV等)比组成型活动启动子(如EF1α、PGK)更常用。
载体骨架和启动子
载体骨架包含表达CAR所需的所有元件,包括启动子、转录调控片段和聚腺苷酸化信号(polyA信号)。特定启动子的选择对转基因的表达水平有直接影响,且可能受到scFv序列本身的影响。目前,尚难以确定CAR-NK细胞的最佳启动子。但已有研究报道,在原代CAR-NK和CAR-NK细胞系中,病毒启动子(如CMV、MPSV、MMLV、SFFV等)比组成型活动启动子(如EF1α、PGK)更常用。
2
信号肽
CAR序列从一个短信号肽(SP)开始,信号肽中存在着巨大的异质性,这与不同水平的蛋白质分泌效率相关。目前CD8a-SP是原代NK细胞最常用的信号肽序列。尽管信号肽序列可能影响CAR的表达水平,但目前还没有数据确定CAR-NK的最佳SP。
信号肽
CAR序列从一个短信号肽(SP)开始,信号肽中存在着巨大的异质性,这与不同水平的蛋白质分泌效率相关。目前CD8a-SP是原代NK细胞最常用的信号肽序列。尽管信号肽序列可能影响CAR的表达水平,但目前还没有数据确定CAR-NK的最佳SP。
3
单链抗体片段(scFv)
scFv是CAR的肿瘤抗原结合域,不同的scFv可以结合相同蛋白质的不同表位,该结构域与CAR-NK细胞的特异性和功能有关。scFv的轻链和重链顺序是人为确定的,对于CAR-NK的设计,大部分研究人员更偏向于VH-VL方向。有研究表明,即便是靶向相同抗原的scFv也会影响CAR表达的结果。
单链抗体片段(scFv)
scFv是CAR的肿瘤抗原结合域,不同的scFv可以结合相同蛋白质的不同表位,该结构域与CAR-NK细胞的特异性和功能有关。scFv的轻链和重链顺序是人为确定的,对于CAR-NK的设计,大部分研究人员更偏向于VH-VL方向。有研究表明,即便是靶向相同抗原的scFv也会影响CAR表达的结果。
而单个免疫细胞可以配备多个scFv,这也扩大了CAR效应细胞识别抗原的能力。CAR-T细胞疗法上的做法或许可以提供参照:一种是CAR可以选择具有双顺反子原件的载体转导,诱导两种CAR的表达;另一种可以将两个scFv融合到一个构建体中,从而产生串联的scFv或“sing stalk”CAR。尽管无论是鼠源的还是人源的单链抗体,都有可能诱导宿主抗独特型抗体的免疫反应,但从目前所做的临床研究来看,尚未在CAR-NK试验中发现与抗CAR免疫反应相关的重大副作用。
4
连接区
将重链与轻链进行连接的连接区可以稳定scFv的构象,部分决定了CAR识别靶表位的能力。对于CAR-NK而言,五肽GGGGS的多聚体应用最为广泛,另一种常用的是Whit low“218”。
连接区
将重链与轻链进行连接的连接区可以稳定scFv的构象,部分决定了CAR识别靶表位的能力。对于CAR-NK而言,五肽GGGGS的多聚体应用最为广泛,另一种常用的是Whit low“218”。
5
铰链区
铰链区负责将scFv连接到跨膜结构域,通常维持效应细胞中CAR表达和活性的稳定性。大部分CAR-NK采用的是CD8α或CD28胞外结构域的衍生物或基于IgG的铰链区。而CD28相较于CD8α更能促进细胞分子二聚化,使得CAR的激活刺激更强,但也可能导致细胞因子释放综合征。基于IgG铰链区的研究发现,其构建更具灵活性。目前,大部分原代NK细胞、CAR-NK细胞系使用的是CD8α铰链区。
铰链区
铰链区负责将scFv连接到跨膜结构域,通常维持效应细胞中CAR表达和活性的稳定性。大部分CAR-NK采用的是CD8α或CD28胞外结构域的衍生物或基于IgG的铰链区。而CD28相较于CD8α更能促进细胞分子二聚化,使得CAR的激活刺激更强,但也可能导致细胞因子释放综合征。基于IgG铰链区的研究发现,其构建更具灵活性。目前,大部分原代NK细胞、CAR-NK细胞系使用的是CD8α铰链区。
6
跨膜(TM)结构域
跨膜结构域将CAR的胞外域连接到胞内激活结构域,TM结构域的选择影响了CAR结构在功能上活化的程度,其具体来源将决定CAR-NK的活性。最佳的TM结构域应该遵循T细胞或NK细胞上跨膜蛋白的天然取向(N-端到C-端的顺序)。目前,CD8α和CD28衍生的TM结构域在原代CAR-NK细胞中最为常见,CD28是CAR-NK细胞系的首选。
跨膜(TM)结构域
跨膜结构域将CAR的胞外域连接到胞内激活结构域,TM结构域的选择影响了CAR结构在功能上活化的程度,其具体来源将决定CAR-NK的活性。最佳的TM结构域应该遵循T细胞或NK细胞上跨膜蛋白的天然取向(N-端到C-端的顺序)。目前,CD8α和CD28衍生的TM结构域在原代CAR-NK细胞中最为常见,CD28是CAR-NK细胞系的首选。
下一代CAR-NK
通过对上述各个结构域的优化,CAR-NK的CAR分子已经发展至第四代。第一代CAR分子包含一个合成的细胞外受体、一个跨膜域和一个细胞内信号域;第二代和第三代的CAR分子分别具有一个或多个细胞内共刺激结构域,共刺激分子通常来源于CD28家族、TNFR家族或SLAM相关受体家族。
有研究小组构建了具有CD28和4-1BB共刺激结构域的第三代CD33靶向CAR,并转导了NK-92衍生的NK细胞。在1期研究中给375名R/R AML患者回输,结果证明了该疗法的安全性,但未获得持久的疗效,这一结果归因于受辐射的NK-92细胞在体内的持久性有限。故而研发人员正探索更多样化的CAR-NK疗法,以解决其存在的局限性。
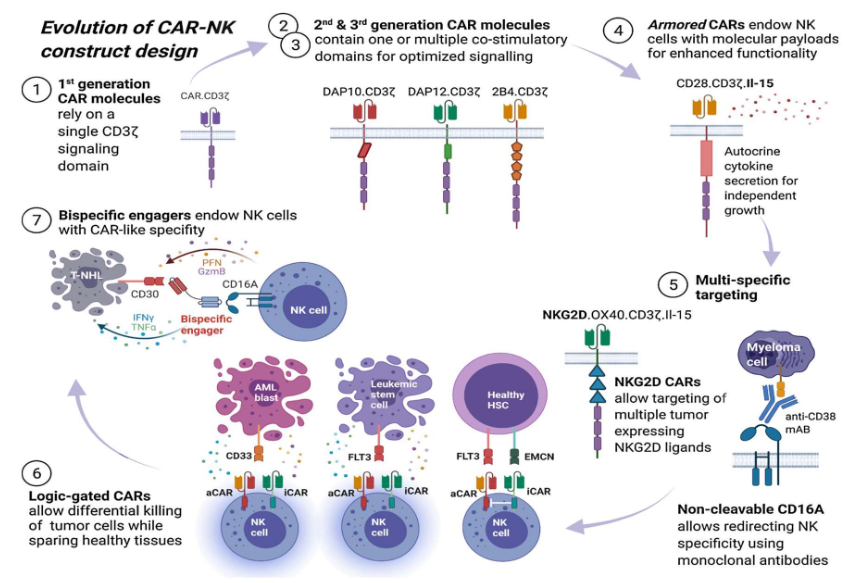
CAR-NK升级
前三代CAR结构的设计依赖于生理上发生的免疫细胞受体结构域,而第四代CAR又被称为“武装”CAR,则采用了一种截然不同的方法,加入了分子有效载荷,赋予CAR工程细胞额外的特性和功能,以解决免疫细胞疗法存在的固有限制。此外,还有双特异性/多特异性靶向CAR、逻辑门控CAR等多种经过优化升级的CAR类型。
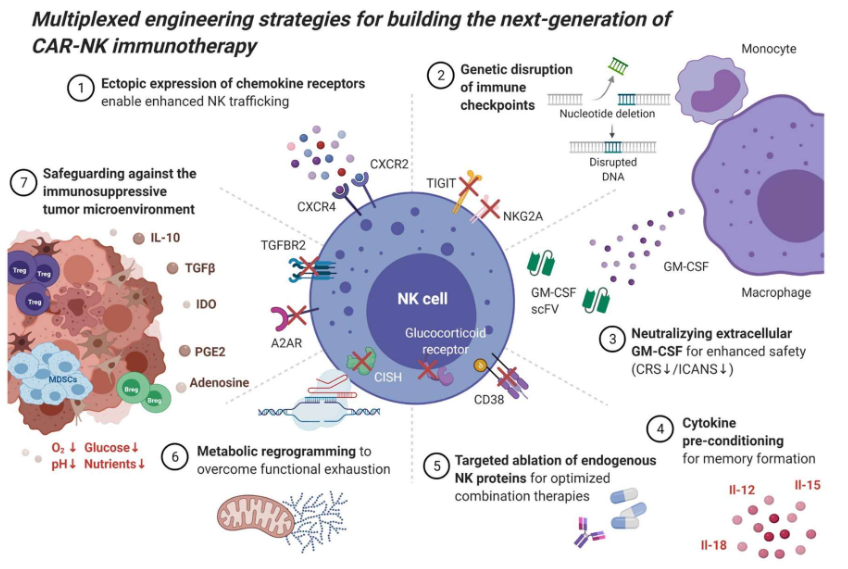
7大工程化策略
这些“下一代”CAR-NK疗法主要采用了7大工程化策略以提升持久性和抗肿瘤活性:
-
异位表达趋化因子受体增强NK细胞的运输和浸润肿瘤的能力;
-
敲除NK免疫功能负调节因子基因有助于克服功能衰竭;
-
中和scFv可以阻断已经与CRS/ICANS连接的细胞外GM-CSF;
-
利用II-12/15/18细胞因子预处理诱导具有增强效力的忆样NK细胞形成;
-
敲除表面和细胞内分子防止自相残杀或免疫抑制来调节NK细胞进行联合治疗;
-
通过干预代谢途径使得NK细胞能够抵抗功能衰竭机制;
-
抑制性受体的靶向基因消融可以保护CAR-NK细胞对抗免疫抑制性肿瘤微环境。
1
第四代CAR-NK
第四代CAR-NK可以包含多个理想的基因修饰,比如添加IL-15细胞因子基因,以保持CAR-NK在体内的持久性和抗肿瘤活性。CAR-NK赛道的头部企业Nkarta曾称其先导产品NKX101为“第四代”CAR-NK疗法,NKX101的CAR经过工程改造,可表达与共刺激(OX2)和信号传导(CD40ζ)结构域融合的嵌合NKG3D受体,这一受体能够在目标肿瘤细胞中找到最多8种相关配体。此外,NKX101还表达白细胞介素-15作为自分泌生长因子,从而增加持久性。
第四代CAR-NK
第四代CAR-NK可以包含多个理想的基因修饰,比如添加IL-15细胞因子基因,以保持CAR-NK在体内的持久性和抗肿瘤活性。CAR-NK赛道的头部企业Nkarta曾称其先导产品NKX101为“第四代”CAR-NK疗法,NKX101的CAR经过工程改造,可表达与共刺激(OX2)和信号传导(CD40ζ)结构域融合的嵌合NKG3D受体,这一受体能够在目标肿瘤细胞中找到最多8种相关配体。此外,NKX101还表达白细胞介素-15作为自分泌生长因子,从而增加持久性。
目前,第四代CAR-NK的研究较少,clinicaltrials.gov官网已显示有多条第四代CAR-T疗法的相关研究,CAR-T疗法的进展较CAR-NK快,其CAR结构有着共通之处,在CAR的加载技术更加成熟后,想必第四代CAR-NK的研发将会更加顺利。
2
双特异性/多特异性CAR-NK
实体瘤具有高度异质性,即使是同一个病灶的肿瘤也可能表达不同的肿瘤相关新抗原,单一靶向的细胞疗法往往面临着挑战,而双特异性/多特异性靶向的方法有望解决异质性问题,犹如编织了一个更大的“网”,将更多肿瘤细胞一网打尽。
双特异性/多特异性CAR-NK
实体瘤具有高度异质性,即使是同一个病灶的肿瘤也可能表达不同的肿瘤相关新抗原,单一靶向的细胞疗法往往面临着挑战,而双特异性/多特异性靶向的方法有望解决异质性问题,犹如编织了一个更大的“网”,将更多肿瘤细胞一网打尽。
目前,已有企业在探索双特异性靶向CAR-NK。Cytovia Therapeutics曾宣布从CytoImmune获得了其首创的用于胶质母细胞瘤和其他实体瘤的双靶向CAR-NK的全球性产品权益。CytoImmune的创始人Michael A. Caligiuri博士及其团队构建了一种能够靶向表达EGFR野生型和/或突变EGFR vIII的的EGFR双靶向CAR-NK,这一疗法在动物模型中显示出统计学上的显著改善。
另外,Jeffrey Miller团队曾在2021年报道了其研究成果,构建了一种多特异性B7-H3靶向的iPSC来源的CAR-NK,具有广谱抗癌的潜力。不过这一概念较为前沿,真正落地还需要走很长一段路。
3
逻辑门控CAR-NK
逻辑门控CAR也称为非门CAR,这种CAR将肿瘤中缺失的抗原作为激活免疫系统的靶标,能够抑制T细胞与正常细胞上的抗原结合,从而有效避免“脱靶效应”。
逻辑门控CAR-NK
逻辑门控CAR也称为非门CAR,这种CAR将肿瘤中缺失的抗原作为激活免疫系统的靶标,能够抑制T细胞与正常细胞上的抗原结合,从而有效避免“脱靶效应”。
合成生物学大牛卢冠达创办的Senti Bio曾在2021年举办的第36届癌症免疫治疗学会年会上展示一种逻辑门控同种异体CAR-NK疗法SENTI-401,将癌胚抗原(CEA)靶向激活CAR与抑制性CAR配对,后者负责识别在某些健康胃肠道和肺上皮细胞中独特表达的安全抗原(SA),这一设计能够靶向和杀死表达CEA的肿瘤细胞,同时避开表达CEA的健康上皮细胞。
在临床前评估中,SENTI-401能够有效杀死大肠癌细胞,并保护健康细胞,同时降低了毒性。2023年1月,Senti Bio宣布将优先推进逻辑门控细胞疗法SENTI-401和SENTI-202。值得一提的是SENTI-202也是一种逻辑门控现成的CAR-NK细胞候选产品,旨在靶向和消除AML细胞,同时保留健康的骨髓,预计将在今年下半年提交IND申请。

2022年7月,德克萨斯大学MD安德森癌症中心的研究人员在Nature Medicine上发表了一篇文章报道了一种。研究人员发现“胞啃”的生理过程通过引起肿瘤抗原丢失、NK细胞衰竭和自相残杀,促成了肿瘤逃逸和CAR-NK细胞治疗后反应不佳。在这一过程中,靶细胞表面蛋白会转移到免疫细胞表面以引发自相残杀的现象。
研究人员给CD19 CAR-NK细胞添加了一种旨在识别NK细胞特有的标志物的抑制性CAR,即使NK细胞表面携带肿瘤抗原,也可以通过第二个CAR向同类表达“不要杀我”的信号。在临床前肿瘤模型中,逻辑门双靶向CAR-NK能够更好地聚集肿瘤细胞,减少了NK细胞耗竭及自相残杀。
总结
尽管当下尚未有CAR-NK疗法获批上市,但其在治疗实体瘤中的优势使得这一疗法备受期待。一位CAR-T研发人员曾表示:“人们对后来上市的CAR-T疗法往往有更多的期待,所以我们在一代CAR-T疗法的同时也会推进迭代产品的研究。”在其他赛道如TIL疗法也不例外,TIL龙头企业Iovance除了申报其核心管线LN-144外,已经布局了第三代TIL疗法。同理,CAR-NK疗法亦如是,想必随着CAR的结构升级,CAR-NK疗法的疗效和安全性也将大大提升。
来源:医麦客



